Nature Communications | 姜晓谦课题组提出MOF基纳米材料介导RNAi抗虫效率增强的新策略

近年来,随着RNA干扰 (RNAi) 技术在农业害虫防控领域的快速发展,纳米材料作为双链RNA (dsRNA) 的递送载体已成为研究热点。外源喷施靶向昆虫必需基因的双链RNA(dsRNA)已被证明是一种能够有效防治害虫的有效策略。然而,利用裸露dsRNA介导的RNAi技术对作物保护作用还十分有限,特别是外裸露的dsRNA在鳞翅目/直翅目昆虫肠道细胞中摄取效率极为低下。开发具有智能响应、高效负载和提供dsRNA稳定性能的纳米材料递送技术有望解决上述问题。除了考虑到利用纳米材料增强dsRNA分子稳定性和递送效率进而增强RNAi的效率,叶面喷施纳米材料如何影响植物-昆虫-微生物互作从而提高RNAi效率方面的研究报道仍然知之甚少。
近日,我院姜晓谦副教授课题组在Nature Communications上发表了题为“Increased and synergistic RNAi delivery using MOF polydopamine nanoparticles for biopesticide applications”研究论文,利用金属有机骨架ZIF-8修饰后的ZIF-8@PDA(ZIF-8@PDA)纳米递送体系,揭示了MOF基纳米颗粒如何诱导肠道细菌的失调加速其介导RNAi致死草地贪夜蛾。该研究发现,与叶面喷施裸露的dsRNA介导的RNAi技术相比,ZIF-8@PDA递送技术对草地贪夜蛾的防治效果更强,同时将昆虫肠道细菌和ZIF-8@PDA递送技术相结合应用于对草地贪夜蛾的防治,探明了肠道细菌沙雷氏菌(Serratia marcescens)能够加速ZIF-8@PDA-RNAi致死草地贪夜蛾的作用及机制。
1.dsGFP@ZIF-8@PDA NPs的自组装机制及其增强的dsRNA递送
图1a、b和图1c-e图显示,dsGFP、dsGFP@ZIF-8及dsGFP@ZIF-8@PDA纳米颗粒均呈现多面体球形形貌。通过高斯概率分布模型(R²=0.897)计算得出dsGFP@ZIF-8@PDA纳米颗粒平均直径为109.08 ± 0.8 nm(图1f)。ZIF-8、dsGFP@ZIF-8和dsGFP@ZIF-8@PDA的ζ电位变化(图1g)表明三者间存在静电相互作用。热力学分析显示,1.5E-6 M−1的低解离常数(Kd)(图1h)证实Zn²⁺与2-mIm存在强效结合。ΔH(28.33 kJ mol−1)与TΔS(61.56 kJ mol−1)正值表明ZIF-8的自组装为吸热过程,主要由静电作用与熵增驱动。631 E-9 M−1的超低解离常数(图1i)揭示dsGFP与ZIF-8存在强烈相互作用,负ΔG值(−35.37 kJ mol−1)证实该过程可自发进行(图1j)。负ΔH值(−44.7 kJ mol−1)与TΔS值(−9.33 kJ mol−1)表明dsGFP与ZIF-8间存在静电作用与范德华力。电泳结果证实ZIF-8@PDA纳米载体可保护dsRNA免遭酶解,而裸露dsRNA在草地贪夜蛾血淋巴(HL)与肠液(GF)中迅速降解。为验证吸收效率,将Cy3标记的裸露dsGFP(红色荧光)进行实验。体内实验显示,ZIF-8@PDA包裹的Cy3-dsGFP在草地贪夜蛾肠道组织中的荧光强度较裸露Cy3-dsGFP提升12.33倍。体外Sf9细胞实验观察到357.9倍的荧光增强效应(图2l,附图3b)。这些结果充分证明ZIF-8@PDA纳米颗粒能显著促进dsRNA吸收,有效突破dsRNA递送瓶颈。
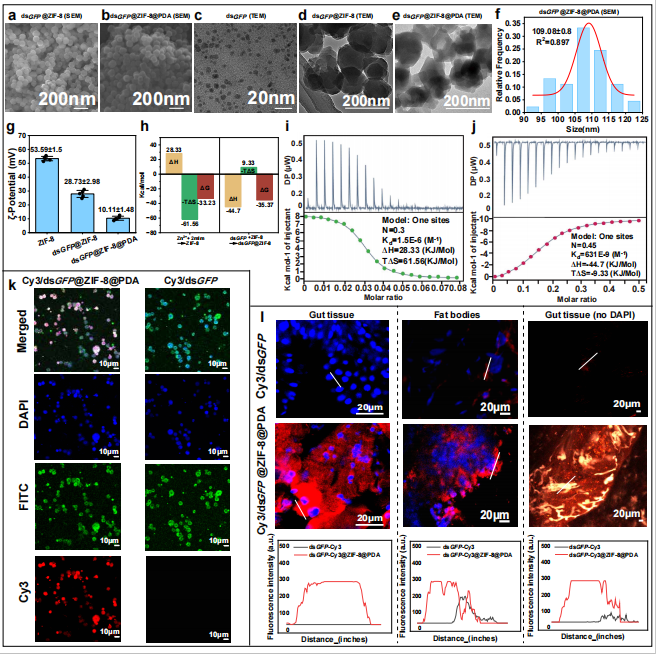
图1.ZIF-8@PDA纳米颗粒增强了dsRNA分子稳定性和摄取能力。
2.纳米 dsRNA@ZIF-8@PDA 通过激活内吞作用和吞噬体来增强 dsRNA 摄取
为探究ZIF-8@PDA复合体介导的dsRNA递送机制,本研究对喂食dsCHS@ZIF-8@PDA与裸露dsCHS的草地贪夜蛾幼虫进行RNA测序(RNA-seq)结合实时定量PCR(qPCR)分析。KEGG通路分析显示,差异表达基因(DEGs)显著富集于内吞作用、吞噬体、Toll和IMD信号通路等多个途径(图3a)。通过基因本体(GO)分析将DEGs进一步归类为三大生物学过程,主要涉及免疫应答、胞内/外囊泡运输、共生体与宿主互作等生物学过程,以及跨膜转运蛋白活性等分子功能(图3b)。具体而言,dsCHS@ZIF-8@PDA处理组中胞吞途径相关基因(如网格蛋白重链Chc、Hsp70、Rab35、Rab7、Snx3、E3和AP-2)及吞噬体途径基因(如F-肌动蛋白、V-ATPase-A、Pikfyve、VPS34和Rab35)均呈现上调表达(图3c、e)。

图 3. dsCHS@ZIF-8@PDA激活了昆虫转运和免疫相关途径且肠道微生物群被破坏。
3. S. frugiperda 肠道细菌的改变有助于提高纳米 RNAi 效率
为探究ZIF-8@PDA纳米颗粒对草地贪夜蛾肠道菌群的影响,本研究通过Illumina测序平台对喂食dsCHS@ZIF-8@PDA和dsV-ATPaseB@ZIF-8@PDA的幼虫肠道细菌16S rRNA序列进行分析。α多样性分析显示(Chao1、Observed_otus、Shannon和Simpson指数),与dsGFP、ZIF-8@PDA、dsCHS及dsV-ATPaseB对照组相比,dsCHS@ZIF-8@PDA和dsV-ATPaseB@ZIF-8@PDA处理组的Shannon指数显著降低,Simpson指数显著升高(图3f,ANOVA,Tukey检验,P<0.05),表明纳米颗粒干预导致肠道菌群多样性降低。
基于Bray-Curtis距离的主坐标分析(PCoA)显示六组样本的菌群结构显著分离(图3g),证实dsRNA@ZIF-8@PDA处理能改变幼虫肠道微生物群落结构。在dsGFP、dsCHS和dsV-ATPaseB处理组中,肠球菌属(Enterococcus sp.)为优势菌群(图3h);而ZIF-8@PDA及其负载dsRNA的处理组则显著降低肠球菌比例,同时沙雷氏菌属(Serratia sp.)丰度明显上升(图3h-k),提示ZIF-8@PDA纳米颗粒具有调控沙雷氏菌富集的作用。为验证沙雷氏菌过度增殖的协同致死效应,本研究通过抗生素处理构建无菌草地贪夜蛾种群(图4a-c)。结果显示,dsCHS@ZIF-8@PDA+粘质沙雷氏菌(S. marcescens,OD600=0.1)处理组的幼虫存活率(26.67%)显著低于dsCHS@ZIF-8@PDA+蒙氏肠球菌(E. mundtii,OD600=0.1)组(55.33%)和PBS对照组(55.67%)(图4d)。血淋巴感染实验证实两种菌均能有效侵染(图4e),说明ZIF-8@PDA诱导的沙雷氏菌增殖是促进RNAi干扰增强杀虫效果的又一关键因素。本研究发现,与PBS和E. mundtii处理组相比,dsCHS@ZIF-8@PDA+ S. marcescens处理的无菌幼虫在24小时内20-羟基蜕皮酮(20E)滴度显著升高(图4g)。作为关键体液免疫分子,20E通过激活Toll/IMD通路相关基因(图4i-l)诱导ROS积累(图4f,g,m)。特别是在处理48小时内,S. marcescens组Toll/IMD通路基因表达显著上调(图4i-l),证实该菌可通过Toll/IMD通路激活宿主免疫应答。

图 4. 接种到S. fruciperda 的粘质链球菌S. marcescens过度生长激活和ROS 免疫反应受到抑制。
我们通过反向验证实验发现,无菌培养的三龄幼虫在喂食含有SM菌(OD600=0.1)及dsCHS@ZIF-8@PDA的饲料后,当Toll/IMD通路关键基因(β-1,3-GBP、Mapkk4、PGPR、Ankyrin、Duox和Toll)被siRNA敲除时,会表现出ROS抑制和沙雷氏菌增殖现象(图5c-e,l),并导致死亡率显著加速(图5a,b)。qPCR定量分析进一步证实上述免疫基因的表达抑制(图5f-k)。这些结果表明Toll/IMD通路基因参与ROS生成,其敲除会严重损害宿主抵抗外源胁迫和抑制病原菌过度增殖的能力(图5f-k)。值得注意的是,体外实验证明ZIF-8和ZIF-8@PDA(>50mg/L)会抑制沙雷氏菌生长,表明昆虫肠道内宿主来源的应激信号是沙雷氏菌体内过度增殖的必要条件(附图9t,u)。ZIF-8和ZIF-8@PDA纳米颗粒在中肠组织诱导剂量依赖性ROS生成(50-200mg/L),其中ZIF-8的氧化应激诱导效应显著更强(同等浓度下比ZIF-8@PDA高1.58倍,P<0.001)(附图9h,i)。维生素C介导的ROS清除(约74%)可99.9%抑制SM菌生长(P<0.001),证实ROS是触发SM菌扩增的关键因素(附图9j-m)。这些结果确证ZIF-8@PDA纳米颗粒诱导的ROS升高导致沙雷氏菌过度增殖。进一步实验显示纳米载体与沙雷氏菌共同处理比单独使用纳米载体产生更强的ROS爆发,表明沙雷氏菌过度增殖会进一步诱导ROS爆发(附图9j-m),形成自我强化的氧化应激循环。这些发现阐明ZIF-8@PDA纳米颗粒诱导的ROS生成引发沙雷氏菌过度增殖,而菌体过度增殖又导致宿主体内ROS爆发,最终对昆虫产生不利影响。

图 6:粘质链球菌S. marcescens负责灵菌红素的产生并抑制宿主 ROS 免疫。
我院博士研究生高州为论文第一作者,我院姜晓谦副教授和福建农林大学Christopher Rensing教授为共同通讯作者,我院谭金芳教授、李晓云副教授,福建农林大学王杰副教授、Mohammed Esmail Abdalla Elzaki出站博士后,中国农业科学院油料作物研究所的沈晨辉副研究员均对本研究提出宝贵意见。本研究工作获得国家自然科学基金等项目的资助。
网址链接:https://doi.org/10.1038/s41467-025-61604-5
初稿:高州 初审:姜晓谦 审核:辛国荣 终审:杨德胜



